Рассмотрены современные представления генетических основ детерминации пола у птиц. Подчиняясь генотипическому механизму определения пола, птицы реализуют сложную систему взаимодействий половых хромосом. Z хромосома содержит доза — зависимую детерминанту мужского пола – ген DMTR1, что обеспечивает развитие семенников при наличии двух копий в комбинации ZZ. Еще не идентифицированные факторы на W хромосоме, с одной стороны, подавляют активность гена DMTR1, а с другой – активируют фермент ароматазу, что, в комбинации ZW способствуют развитию женского пола.
style="display:inline-block;width:336px;height:280px"
data-ad-client="ca-pub-4037835599918832"
data-ad-slot="7553000704">
Выдвинуто предположение, согласно которой по мере появления в ряду различных классов животных приспособлений, обеспечивающих стабильность зародышевого развития, снижается зависимость половой детерминации от внешних условий и внутренних сигналов на поздних стадиях эмбриогенеза. И в то же время появляются закрепленные на генетическом уровне половые детерминанты, активные на самых ранних стадиях развития.
Введение.
Повышенный интерес к половой детерминации у птиц объясняется несколькими причинами: 1. За последние 20-30 лет достигнут значительный прорыв в понимании молекулярно-генетических основ регуляции половой дифференциации у позвоночных животных – прежде всего благодаря применению новейших технологий анализа генома и генной активности. 2. Благодаря внедрению интенсивных технологий в птицеводстве и, прежде всего новейших биотехнологических и инкубационных технологий повысился роль продуктов птицеводства как источника высококачественного белкового продукта. В связи с этим автоматизируются все звенья в цепи производства, включая сбор яиц, их оценка, инкубация, вакцинация молодняка, выращивание птицы, убой, переработка и упаковка. 3. Решение проблемы ранней диагностики пола или управления половой детерминации птиц позволит сэкономить значительные финансовые, энергетические и пищевые ресурсы. Появится возможность инкубации или же производства яиц только определенного пола. 4. В странах с высоким уровнем жизни в последние годы все чаще подымается этическая сторона проблемы, связанная с массовым умерщвлением цыплят (в частности, петушков) в яичном птицеводстве, в связи с неэкономичностью их выращивания на мясо.
Целью настоящей статьи является краткий обзор современных представлений о генетических механизмах определения и основных положений по регуляции половой детерминации у птиц.
Генетические механизмы определения пола у птиц.
У птиц, в отличие от млекопитающих, гетерогаметным полом является самка с хромосомной конституцией ZW. У самцов половые хромосомы представлены гомогаметной парой ZZ. Окончательный механизм детерминации пола у птиц до сих пор не выяснен, хотя в последнее время получены убедительные экспериментальные данные, в значительной степени проясняющие данную ситуацию [1, 2, 3, 4].
Первый, наиболее простой механизм детерминации пола, аналогичный тому, что действует у млекопитающих, это предположение о наличии на W хромосоме фактора, детерминирующего самку. W хромосома схожа на Y хромосому млекопитающих; маленького размера, содержит мало активных генов и много повторяющейся ДНК. Считают, что половые хромосомы птиц произошли от аутосомной пары, а W — это деградированная Z хромосома [5].
Неравномерное распределение хромосом у разных полов приводит к разности в дозе генов, которые могут привести к дефектам развития. Зарегистрированы различные отклонения у человека, вызванные анеуплоидией по разным хромосомам: синдром Дауна – трисомия по 21 хромосоме, синдром Эдварда – трисомия по 18 хромосоме, синдром Кляйнфельтера— 47, ХХY и синдром Тернера— 45, Х. Так как на ранних стадиях развития зародыш млекопитающих очень чувствителен к хромосомным отклонениям, только небольшая часть эмбрионов с хромосомными отклонениями доживают до рождения [6]. Известно, что независимо от количества Х хромосом присутствие Y хромосомы у млекопитающих запускает самцовый тип развития: XXY— ососби являются самцами, а ХО самками. К сожалению, у птиц не зарегистрированы анеуплоидные формы по половым хромосомам, и их считают генетическими леталями [7].
В то же время птицы значительно менее чувствительны к отклонениям количества хромосом; зарегистрированы много фактов живых триплоидов или триплоид-диплоид мозаиков [8, 9]. Считают, что в коммерческих стадах 1 из 2000 несушек является интерсексом, проявляя промежуточные свойства самца и самки. Большинство из этих интерсексов являются, или триплоидами ААА/ZZW, или триплоид-диплоид мозаиками. Описаны живые особи триплоидов ZZZ и ZZW, к сожалению, они всегда не фертильны. Мозаики (AAA/ZZZ, AA/ZZ) характеризуются отставанием в эмбриональном развитии, пониженной митотической активностью [10]. Анализ триплоидов (ZZW) показал, что они являются интерсексами [11]. Будучи по фенотипу самками при рождении, они имеют правый семенник, левый овотестис, а к возрасту полового созревания женская составляющая овотестиса дегенерирует и птицы становятся самцами. Можно предположить о присутствии на W хромосоме детерминанты самки, который находится под доза зависимым влиянием Z хромосомы и данная детерминанта не носит доминантный характер [12].
Анализ химер птиц типа ZZ→ZW показал, что первичные половые клетки ZZ способны пройти мейоз в тканях ZW яичника и формировать функциональные ооциты в отсутствие W хромосомы [13]. Таким образом, можно заключить, что присутствие W хромосомы не является обязательным условием для прохождения мейоза и что гены оогенеза, скорей всего, расположены на Z хромосоме или аутосомах.
Разные виды животных разработали различные реакции на дозу хромосом. Млекопитающие контролируют дозу генов половой хромосомы через инактивацию одной Х хромосомы в каждой клетке самки, в комбинации с усилением экспрессии генов в оставшейся Х хромосоме обеих полов [14]. Вопрос, касающийся компенсации дозы генов и половой детерминации у птиц усложняется тем обстоятельством, что у бескилевых птиц практически нет кариотипических различий по Z и W хромосомам [15]. А такие таксономоческие группы птиц, как Соколообразные (Falconiformes), Журавлеобразные (Gruiformes) и Дятлеобразные (Piciformes) имеют сильно увеличенные половые хромосомы (как Z, так и W), делая Z самой крупной хромосомой кариотипа [16]. Связано ли это с увеличением количества генов или их плотности еще не выяснено.
На эухроматиновом плече W хромосомы птиц были открыты два гена, которые могли бы выступить в роли половых детерминантов. Первый из них — это ген ASW [17]. ASW экспрессируется только в эмбрионах женского пола, в основном, в гонадах, в то время как его единственный гомолог на Z хромосоме – ZPKCI – экспрессируется в значительно меньшей степени у обеих полов [17]. Однако, несмотря на многократные повторы гена ASW на W хромосоме, половое развитие триплоидов ZZW показывает, что действие этого гена недостаточно для индукции перманентного развития таких особей по пути формирования самки. Против предположения об определяющей роли гена ASW в детерминации яичника птиц свидетельствует и то обстоятельство, что активность этого гена зафиксирована кроме гонад и в некоторых других тканях [18]. ASW также оказался неспособным индуцировать развитие самки при чрезмерной экспрессии в эмбрионах самцов [2]. Кроме того этот ген не найден у бескилевых птиц [17]. У бескилевых птиц гомоморфные половые хромосомы, но, так же, как и у других представителей класса, генотипическая детерминация пола и, скорей всего, у них общий с другими птицами генетический триггер.
Второй ген — FET1- расположен на эухроматиновом участке короткого плеча W хромосомы, не связан с ASW геном и не имеет гомолога на Z хромосоме. Он экспрессируется исключительно в мочеполовой системе самки в период, предшествующий половой дифференциации (4,5-6,5 сутки; 25-30 стадии развития). Уровень экспрессии FET1 в левой гонаде значительно выше, чем в правой. Этот ген не проявляет гомологии с каким-либо из известных генов и кодирует протеин из 434 остатков с предполагаемой сигнальной последовательностью и трансмембранным доменом. У млекопитающих нет ортологов генов ASW и FET1 [19].
Даже если эти гены окажутся детерминантами яичников у птиц, еще остаются отсутствующие звенья в пути активации ароматазы (см. ниже). ASW/WPKCI и FET1 экспрессируются достаточно раньше активности ароматазы, что делает невозможным непосредственную активацию этого гена без привлечения других факторов [19].
Вторая гипотеза предполагает детерминацию мужского пола птиц двойной дозой генов, сцепленных с Z хромосомой. Необходимым условием для этого является то, что данный ген не должен подвергаться компенсаторному механизму, согласно которому, гены на одной из Z хромосом в комбинации ZZ инактивируются. Хотя активность многих генов на Z хромосоме у самок и самцов выровнены [20], есть данные, что некоторые мРНК транскрибируются с генов обеих Z хромосом в клетках самцов [21]. Поэтому, если у птиц и происходит компенсация дозы генов в ходе раннего развития, то этому механизму подвержена не вся хромосома, в отличие от млекопитающих. Одним из генов, избегающих компенсации дозы, является ген DMRT1. Этот ген наиболее подходящий кандидат на роль детерминанта мужского пола у птиц. Он находится на Z хромосоме, но не имеет гомолога на W хромосоме. DMRT1 экспрессируется в гонадах птиц до и в ходе их дифференциации, будучи более активным в семенниках, чем в яичниках [22, 23]. DMRT1 протеин изначально находится в ядрах клеток медуллярных канальцев, где начинается управление процессом формирования семенников. Более того, в клетках генетических самок, у которых произошла реверсия пола под влиянием ингибитора ароматазы, активность DMRT1 возрастает, несмотря на присутствие в одной копии [24]. DMRT1 –пример консервативности полоопределяющих генов у различных типов животных, так как его аналоги задействованы в половой дифференциации как млекопитающих, так и насекомых [25].
Согласно данным Smith C.A. и др., которые подтверждают дозазависимую гипотезу половой детерминации у птиц, высокие дозы гена DMRT1 инициируют дифференциацию семенников у самцов, активируя экспрессию гена SOX9 и подавляя активность ароматазы [2]. Ген DMRT1 полностью отвечает требованиям к половой детерминанте птиц. Этот ген, сцепленный с полом, находится на Z хромосоме у всех птиц, включая бескилевые [26]. Он экспрессируется исключительно в мочеполовой системе перед половой дифференциацией гонад эмбрионов птиц. У других позвоночных DMRT1 также задействован в развитии семенников. Нуль мутации по DMRT1 нарушает постнатальное развитие семенников у мышей, а делеции по этому гену у человека вызывают тестикулярный дисгенез. У рептилий, с температурной детерминацией пола, концентрация DMRT1 увеличивается в термочувствительный период, когда определяется пол, и только при самцовой температуре [27, 28]. У рыбы медака Oryzias latipes двойная копия DMRT1, dmy/dmrt1b является ведущим детерминантом семенников, а у амфибий копия DMRT1, сцепленная с W, dmw определяет развитие яичников [29]. Таким образом, DMRT1 может оказаться доза чувствительным наследственным половым детерминантом как у птиц, так и у низших позвоночных, который заменяется геном SRY у млекопитающих.
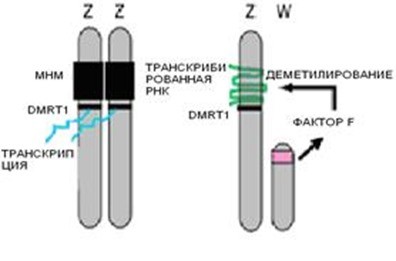
Новая модель половой детерминации эмбрионов кур включает непосредственное взаимодействие фактора, производного W хромосомы, и Z хромосомы. Teranishi с коллегами обнаружили на коротком плече Z хромосомы гиперметилированный участок (МНМ), состоящий из более чем 200 копий тандемных повторов размером 2,2 kb [30]. Этот участок гиперметилирован и транскрипционно неактивен на обеих Z хромосомах самцов и транскрибируется только на единственной Z хромосоме самок. МНМ участок не транслируется и высокомолекулярная некодирующая РНК обволакивает участок на Z хромосоме самок, прилегающий к DMRT1 локусу. Интересно, что в триплоидах ZZZ все три Z хромосомы гиперметилированы и неактивны, в то время как в триплоидах ZZW МНМ район гипометилирован и транскрибируется с обеих Z хромосом [30]. Эти данные свидетельствуют о вовлечении W хромосомы в статус метилирования МНМ участка Z хромосомы. Возможно, что в ZW эмбрионах W-производный фактор индуцирует гипометилирование МНМ участка и транскрибированная РНК обволакивает Z хромосому, подавляя транскрипцию близлежащих генов, включая DMRT1. У ZZ самцов в отсутствие W хромосомы МНМ участок остается гиперметилированным и неактивным, не производится РНК и не происходит подавления активности DMRT1 (рис.1).
Рис.1. Модель половой детерминации у птиц, включающий непосредственное взаимодействие Z и W хромосом. Гиперметилированный участок MHM на ZZ хромосомах у самцов транскрипционно неактивен. Соседние полоспецифические гены самца, такие как DMRT1свободны и транскрибируются. В ZW эмбрионах, протеин кодируемый W хромосомой (Фактор F) индуцирует деметилирование MHM участка, что приводит к активной транскрипции высокомолекулярной некодирующей РНК, которая накапливается на месте транскрипции. Транскрипция соседних генов, таких как DMTR1 снижается. (Модифицирован из Smith C. and Sinclair A. [19]).
Если предположить, что роль фактора F выполняет продукт гена FET1, то результатом подавления его активности должен быть эффект, наблюдаемый при подавлении активности ароматазы, т.е. реверсия пола в сторону самца. Нокдаун гена FET1 позволил бы прояснить данное предположение, как это было сделано с геном DMRT1 [2].
Смещение полового соотношения в результате нарушения сегрегации половых хромосом.
Задав вопрос о возможности управления детерминацией пола у птиц нельзя умолчать о таком явлении как первичное смещение полового соотношения за счет нарушения сегрегации половых хромосом во время мейоза, или, так называемый, мейотический драйв половой хромосомы.
Нарушители сегрегации – это аллели, которые нарушают нормальную сегрегацию хромосом по своему усмотрению. Нарушение сегрегации возникает в целом ряде таксономических групп организмов от грибов до растений и животных. Аллели — нарушители присутствуют в более чем 90% функциональных гамет. Однако эффективное смещение сегрегации может варьировать от 0,5 до почти 1 [31].
Когда нарушители сегрегации локализованы на половой хромосоме, они не только влияют на приспособленность особи, но также смещают половое соотношение в популяции [32]. Нормальное половое соотношение может быть восстановлено или путем подавления нарушителя, или изменением механизма половой детерминации [33].
Драйв половой хромосомы означает неравную передачу половых хромосом от особей с гетерогаметным полом, что приводит к смещенному половому соотношению у потомков и внутри популяций [32]. В большинстве случаев нарушение сегрегации происходит в ходе сперматогенеза в результате нерасхождения Y хроматид в мейозе II, или повреждения Х хромосомы, приводящей к неспособности развития сперматид [34]. У мухи Trichosia pubescens в сперматогенезе гетерогаметного самца наблюдается не случайное расхождение хромосом в мейозе, что приводит к формированию гамет одного типа, несущих только материнский набор хромосом. Формирование одного типа гамет в данной системе становится возможным благодаря присутствию монополярного и моноцентрического веретена в первом делении мейоза, что является результатом инактивации кинетохоров отцовских хромосом, которые неспособны захватывать микротрубочки веретена. [35].
Мейотический драйв самки известен значительно меньше. У бабочки Eucheria socialis westwoodi гетерогаметными являются самки, которые могут продуцировать потомство со строго смещенным в сторону самцов половым соотношением [36], вероятно, за счет не случайного расхождения хромосом в мейозе самки. У некоторых млекопитающих гетерогаметные самки с Х и Y хромосомами демонстрируют мейотический драйв. Например, у древесных леммингов Myopus schisticolor гетерогаметные самки продуцируют только ооциты, несущие Х хромосомы [37], как возможный результат элиминации Y хромосомы на стадии первичных половых клеток или оогониев.
Другие механизмы мейотического драйва половых хромосом основаны на цитоплазматических элементах, ответственных за смещенное в сторону самок половое соотношение [32]. Наконец, аутосомные нарушители сегрегации могут действовать через предотвращение конденсации гетерохроматина в ядрах сперматозоидов и формирования сперматид. У растений мейотический драйв часто вызывается производством нежизнеспособных гамет самцов [34].
Несмотря на то, что генетический механизм детерминации пола, характерный для птиц, не предполагает получение стабильного смещения полового соотношения, довольно широко распространено и регистрировано явление адаптивного изменения полового соотношения в связи с социальными и физиологическими условиями воспроизводства. Считают, что птицы должны обладать значительно более развитыми способностями в отношении смещения полового соотношения по сравнению с млекопитающими в связи с гетерогаметностью самки и в связи с тем, что полоопределяющее деление мейоза у птиц происходит перед овуляцией и оплодотворением. По мнению Rutkowska J. и Badyaev A. значительные различия между половыми хромосомами по размеру, форме, по размеру белковых тел, расположению мейотической пластинки, прикреплению хромосом к микротрубочкам и эпигенетические маркировки половых хромосом должны привести к смещению сегрегации половых хромосом в обычных условиях с вторичной эволюцией компенсаторных механизмов необходимых для поддержания несмещенного мейоза [38]. Все эти обстоятельства делают детерминацию пола птиц особенно чувствительной к материнским влияниям. Данное предположение подтверждается наблюдениями по смещению полового соотношения в зависимости от расположения яйца в кладке и особенностями роста ооцита у птиц [39].
Среди позвоночных животных птицы обладают в высокой степени непосредственным контролем пола потомства благодаря гетерогаметности самки, а также периферическому расположению мейотической пластинки в ооците и времени первого деления мейоза непосредственно перед овуляцией.
Rutkowska J. и Badyaev A. выделяют ряд гипотез, которые могут объяснить механизмы нарушения сегрегации половых хромосом, приводящих к смещению полового соотношения у птиц [38]:
1. диморфизм размера половых хромосом способствует их неслучайной сегрегации;
2. нарушение сегрегации половых хромосом может происходить за счет диморфизма расположения центромеры;
3. теломеры, удлиненные в ходе созревания ооцита, влияют на движение хромосом на некоторых стадиях мейоза, включая их расположение в яйце перед сегрегацией;
4. эпигенетическая маркировка хромосом делает возможным идентификацию определенной половой хромосомы и может повлиять на ее движение в ходе сегрегации;
5. слияние протеинов сцепления может повлиять на расположение хромосомы в зародышевом пузырьке перед разрывом его мембраны;
6. перемещение хромосом в сторону экваториальной части веретена во время мейоза направляется филаментами актина, которые испытывают сильное влияние материнских гормонов;
7. размер центромеры влияет на прикрепление микротрубочек к кинетохору и таким образом ответсвенен за неслучайную сегрегацию хромосом;
8. центромеры и протеины сцепления изменяют функцию кинетохора, влияют на прикрепление микротрубочек и способствуют смещенному половому соотношению;
9. изменение направления сегрегации хромосом в ооцит или в полярное тельце, что может быть результатом поворота мейотического веретена, процесс, который может находиться под влиянием материнских гормонов.
Таким образом, беглое рассмотрение явления неслучайной сегрегации половых хромосом относительно птицы позволяет делать следующие выводы:
1. диморфизм размеров и формы половых хромосом, характер созревания женских половых клеток предрасполагает самок птиц к мейотическому драйву по половой хромосоме;
2. нарушение сегрегации половых хромосом может быть следствием как эпигенетических эффектов, связанных с физиологическим состоянием птицы, так и результатом присутствия алелей — нарушителей нормального хода мейоза;
3. наличие генетически закрепленных факторов, приводящих к смещению полового соотношения, является предпосылкой для проведения специальных исследований по селекции на смещенное половое соотношение в различных популяциях птиц.
Механизмы, лежащие в основе инверсии пола у птиц.
Механизмы детерминации пола позвоночных животных можно грубо объединить на два типа: генотипическая (ГДП) и средовая детерминация пола (СДП). На самом деле эти два типа детерминации пола представляют собой крайности, между которыми существуют множество переходных форм. При ГДП, что наблюдается у млекопитающих, птиц, многих видов рептилий и рыб, один пол продуцирует гаметы гомозиготные по половой аллели или хромосоме (гомогаметные), а другой пол — равное количество двух различных типов гамет (гетерогаметный).
СДП означает, что пол организма безвозвратно определяется в раннем эмбриогенезе условиями окружающей среды: температурой, рН, соленостью воды, социальными условиями, относительными ювенальными размерами [40, 41]. Следует, однако, отметить, что у многих видов рыб смена пола после первичной детерминации является частью нормальной жизни и индуцируется различными стимулами окружающей среды.
Классическая теория Фишера [42] предполагает, что половое соотношение в потомстве должно стремиться к соотношению 1:1, но часто при СДП наблюдается смешение в сторону самцов или самок. Молекулярный механизм, через какой температура запускает детерминацию пола до конца не выяснен, однако работы по влиянию гормонов на половое соотношение подсказывают, что полоопределяющие триггеры действуют через изменение концентрации эстрогенов или их рецепторов [43].
В то время как пол у млекопитающих определяется в момент оплодотворения, у птиц- после первого, редукционного деления мейоза, полоопределяющие гены активируются позже, в ходе эмбриогенеза, включая формирование семенников и яичников. У птиц первичные половые клетки появляются в эпибласте и мигрируют через кровоток в гонады. Первичные гонады и млекопитающих, и птиц формируются из промежуточной мезодермы на вентральной поверхности эмбриональных почек (мезонефроса). Половая дифференциация гонад у птиц может происходить в отсутствие половых клеток [44, 45]. У млекопитающих, в отличие от птиц, для формирования яичников необходимо присутствие мейотических герминативных клеток, хотя семенники могут формироваться и в отсутствие половых клеток [46, 47].
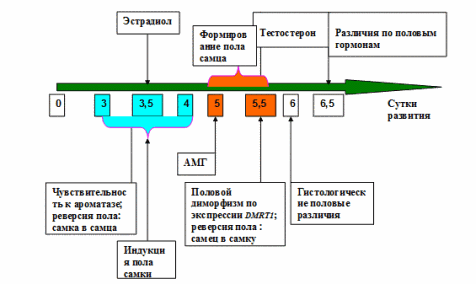
Гонады птиц бипотенциальны на 3,5-4,5 сутки развития. Направление половой дифференциации гонад зависит от того, какая из составляющих гонады- кортекс или медуллярный слой — получит дальнейшее развитие.
У млекопитающих гонадогенез устойчив против действия половых гормонов: развитие зародыша происходит в море гормонов матери. Развитие гонад у птиц более лабильно, будучи чувствительным к обработке гормонами. Реверсию пола можно индуцировать инъекцией in ovo эстрогенов или подавлением их секреции. Таким образом, эстрогены у птиц играют критическую роль в половой детерминации. Синтетические ингибиторы ароматазы, фермента катализирующего синтез эстрогена, могут индуцировать устойчивую реверсию пола самка→самец [48]. Левая гонада маскулинизируется, а правая становится семенником [49]. Критическим фактором, как отмечают авторы, является время воздействия, которая соответствует трем суткам инкубации яиц (см. рис. 2.). Напротив, обработка самцов ZZ эстрадиолом приводит к феминизации, хотя и обратимой. Два важных фермента, необходимых для синтеза эстрогена P-450 ароматаза и 17βHSD, экспрессируются только в гонадах ZW самок в начале морфологической дифференциации. Они вырабатываются в медуллярных канальцах гонад только самок и можно считать их ключевыми компонентами полового диморфизма. Следует обратить внимание на явное противоречие: с одной стороны, как мы отмечали выше, гонады генетических самок наиболее чувствительны к ингибиторам ароматазы на третьи сутки инкубации, а с другой, по данным Nishikimi и др., наиболее ранняя экспрессия ароматазы у птиц регистрируется только на 5-ые сутки развития [50]. Логически было бы предположить, что ген — детерминатор самки на W хромосоме активирует раннюю экспрессию ароматазы и 17βHSD. В то же время, по-видимому, половые гормоны самца: тестостерон и дегидротестостерон не играют какой-либо определяющей роли в раннем развитии самцов [20].
Рис.2. Последовательность событий во времени в ходе детерминации пола у птиц.
Инверсию пола самка→самец можно вызвать пересадкой эмбрионального семенника в генетическую самку перед половой дифференциацией [51]. В этом случае обе гонады развиваются как семенники. Ответственным за реверсию пола считают антимюллеровый гормон (АМГ). АМГ- гликопротеин, секретируемый клетками Сертоли развивающихся семенников. АМГ вызывает регрессию Мюллерового протока у самцов, который в противном случае развивался бы в яичник. У млекопитающих АМГ экспрессируется позже ключевых половых генов, таких как SOX9, которые находятся ниже на путях детерминации семенников. Кроме того, выяснилось, что АМГ не является необходимым компонентом, определяющим формирование семенников у мышей [52]. У птиц гонадная экспрессия АМГ начинается непосредственно перед половой дифференциацией и его активность выше у самцов [53]. Эта разница важна, так как добавление АМГ может вызвать полную реверсию пола у птиц. У млекопитающих экзогенный АМГ также может вызывать формирование семенных канальцев в гонадах самок (так называемый эффект фримартинов). Считают, что это обусловлено эффектом подавления АМГ мейотических половых клеток мышей, а половые клетки у млекопитающих необходимы для формирования яичника [46]. У птиц развитие гонад не зависит от половых клеток [44, 45], поэтому, АМГ может играть более существенную роль в определении самца, возможно, путем подавления экспрессии ароматазы.
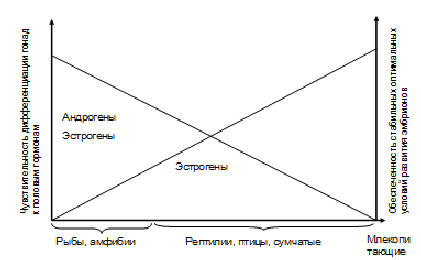
Если проследить филогенетическое древо от рыб до плацентарных млекопитающих, то можно заметить снижение роли стероидных гормонов в половой детерминации. У рыб и амфибий обычным является чувствительность половой дифференциации гонад к андрогенам и эстрогенам [54, 55], у рептилий [56], птиц [57] и сумчатых млекопитающих [58] – к эстрогенам. У плацентарных млекопитающих половая дифференциация гонад не зависит от половых стероидов и может происходить без их участия [59, 60]. Возможно, такая тенденция связана с обеспеченностью стабильных условий вынашивания потомства или инкубации яиц (см. рис.3). По мере появления в ряду различных классов животных приспособлений, обеспечивающих стабильность зародышевого развития, снижается зависимость половой детерминации от внешних условий и внутренних сигналов на поздних стадиях эмбриогенеза. И в то же время появляются закрепленные на генетическом уровне половые детерминанты, активные на самых ранних стадиях развития.
Рис.3. Возможная связь между чувствительностью дифференциации гонад к половым гормонам и уровнем обеспеченности стабильных условий эмбриогенеза.
Согласно палеонтологическим и молекулярно-генетическим исследованиям ближайшими родственниками птиц являются крокодилы, которые относятся к диапсидам. Следует отметить, что кроме птиц для всех групп позвоночных, относящихся к диапсидам: крокодилам, черепахам, змеям и ящерицам характерны как ГДП, так СДП, с возможностью полного смещения пола в ту или иную сторону в зависимости от температуры инкубации яиц. Отличительной особенностью птиц от остальных диапсидов является эволюционное приобретение гомойотермности. Эмбрион птиц представляет собой пойкилотермный организм и поддерживает постоянную температуру тела за счет внешних источников [61]. Однако новорожденный цыпленок быстро становится гомойотермным и уровень потребления кислорода очень быстро возрастает при рождении благодаря уникальной системе дыхания, характерной для птиц. Возможно, у всех диапсидов, включая птиц, работает один и тот же механизм детерминации пола, схожий на описанный выше. Известно, что австралийский бородатый дракон (Pogona vitticeps), проявляя гетерогаметность самки (ZW) при обычных условиях, способен изменить пол ZZ самцов в сторону формирования самок при повышенных температурах [62]. Это указывает на то, что присутствие W хромосомы не является обязательным условием детерминации пола самки у некоторых видов ящериц. Как было отмечено выше, то же самое справедливо и в отношении птиц. Если предположить, что мужским половым детерминантом у этих ящериц является ген DMRT1, как и у птиц, то у некоторых видов могут встречаться формы, кодирующие термочувствительные продукты, которые инактивируются при высоких температурах. Возможно, эффект высокой температуры у австралийской ящерицы можно сравнить с подавлением активности гена DMRT1 у птиц РНК-интерференцией в работе Smith C. A. и др. [2]. Если это действительно так, то вполне оправдан поиск таких форм и среди птиц. И тогда замена DMRT1 у птиц на его термочувствительную форму может позволить целенаправленное получение особей только женского пола.
Исходя из вышеизложенного необратимую инверсию пола у птиц в направлении самка→самец можно индуцировать химическими агентами или изменением внешних условий, влияющими на активность соответствующих ферментов или гормонов. В качестве мишеней таких обработок могут выступать, как гипотетический детерминатор самки на W хромосоме, так и фермент ароматаза, эстрогены или АМГ. Подтверждением сказанному являются результаты исследований, полученных Фергусоном [63, 64]. При обработке яиц слишком высокими или низкими температурами в ходе инкубации были получены 10% особей, у которых половой фенотип (гистологические и макроскопические данные) отличался от полового генотипа (W-специфический молекулярный маркер). Очевидно, температурный фактор, по крайней мере, в некоторых случаях может переопределить влияние генов, детерминирующих пол у птиц. Неизвестно, встречаются ли в природных условиях особи с реверсированным полом, и с какой частотой.
Нами было обнаружено, что при продолжительном хранении яиц некоторых пород кур также происходит смещение полового соотношения в сторону преимущественного формирования самцов [65]. Можно предположить, что для нормальной индукции пола самки на определенной стадии развития (у кур это соответствует третьим суткам инкубации) необходим критически минимальный уровень фермента ароматазы, что, возможно, достигается определенной температурой инкубации и стадией развития зародыша. Известно, что после продолжительного хранения эмбрионы развиваются с большим отставанием, особенно в первую, критическую неделю. Возможно, существуют видо- и породоспецифические аллельные формы ароматазы или гипотетического детерминанта самки на W хромосоме по разному чувствительные к факторам внешней среды.
Таким образом, краткий обзор механизмов, лежащих в основе инверсии пола у птиц, позволяет заключить, что:
1. в начале эмбрионального развития происходит индукция женского пола, которая зависит от активности ароматазы, эстрогенов или АМГ;
2. если по каким-либо причинам не обеспечивается достаточный уровень активности необходимых ферментов или гормонов, то возможна истинная реверсия пола: самка→самец; Это свидетельствует о том, что скорей не двойная доза гена DMRT1 определяет мужской пол у птиц, а соотношение мужских и женских факторов;
3. начало формирования пола самца совпадает с повышением активности гена DMRT1 в будущих семенниках. Подавление активности гена DMRT1 приводит к инверсии пола в сторону самки, но скорей всего, такой подавляющий фактор должен действовать постоянно в ходе развития. Временная обработка эстрогенами приводит только к обратимой инверсии пола.
Литература
1. Алексеевич Л.А. и др. Проблемы детерминации пола у птиц на примере Gallus gallus domesticus. // Генетика. -2009. –Т. 45. -№ 3. –С.293-304.
2. Smith, C. A., Roeszler, K. N., Ohnesorg, T., Cummins, D. M., Farlie, P.G., Sinclair, T. J. Doran, A. H. The avian Z-linked gene DMRT1 is required for male sex determination in the chicken // Nature. -2009. –V. 461. -№ 10. –P.267-271.
3. Reed, K. J., Sinclair, A. H. FET-1: a novel W-linked, female specific gene up-regulated in the embryonic chicken ovary // Mechanisms of Development. -2002. — 119S. -S87–S90.
4. Panagiota, M., Giagkos, L. and Roxani, A. Molecular patterns of sex determination in the animal kingdom: a comparative study of the biology of reproduction // Reproductive Biology and Endocrinology. – 2006. -V. 4. -№ 59.
5. Mizuno, S., Kunita, R. et al. Z and W chromosomes of chickens: studies on their gene functions in sex determination and sex differentiation. // Cytogenet. Genome Res. -2002. -V. 99 (1-4). –P. 236-44.
6. Zaragoza, M. V., Surti, U. et al. Parental origin and phenotype of triploidy in spontaneous abortions: predominance of diandry and association with the partial hydatidiform mole. // Am. J. Hum. Genet. -2000. -V.66. -№ 6. –P. 1807-20.
7. Ellegren, H. Hens, cocks and avian sex determination. A quest for genes on Z or W? // EMBO Reports. -2001. –V.2. -№ 3. –P. 192-196.
8. Abdel-Hameed, F. and Shoffner, R. N. Intersexes and sex determination in chickens. // Science 1971. -V. 172. -№ 986. –P. 962-4.
9. Thorne, M. H., Collins, R. K. et al. Live haploid-diploid and other unusual mosaic chickens (Gallus domesticus). // Cytogenet Cell Genet. -1987. -V. 45. -№ 1. –P. 21-5.
10. Bloom, S. E. and Buss, E. G. Triploid-diploid mosaic chicken embryo. // Science. -1966 -V. 153. -№ 737. –P. 759-60.
11. Thorne, M and Sheldon, B. Triploid intersex and chimeric chickens: useful models for studies of avian sex determination. In: Reed K.C., Graves J.A.M., editors. Sex chromosomes and sex determining genes. Chur, Switzerland: Harwood Academic. -1993. -P. 201–208.
12. Lin, M., Thorne, M. H., Martin, I.C.A., Sheldon, B.L., Jones, R.C. Development of the gonads in the triploid (ZZW and ZZZ) fowl, Gallus domesticus, and comparison with normal diploid males (ZZ) and females (ZW). // Reprod Fert Dev. -1995. -V. 7. -P. 1185–1197.
13. Kagami, H., Clark, M. E, Verrinder Gibbins A. M., Etches, R. J. Sexual differentiation of chimeric chickens containing ZZ and ZW cells in the germline.// Mol. Reprod. Dev. -1995. -№ 42. -P.379–387.
14. Nguyen, D. and Disteche, C. Dosage compensation of the active X chromosome in mammals. // Nat Genet. -2006. -№ 38. -P.47-53.
15. Nishida-Umehara, C., Fujiwara A., et al. Differentiation of Z and W Chromosomes Revealed by Replication Banding and FISH Mapping of Sex-chromosome-linked DNA Markers in the Cassowary (Aves, Ratitae). // Chromosome Research. -1999. –V. 7. -№ 8. -P.635.
16. Ellegren, H. Evolution of the avian sex chromosomes and their role in sex determination. // Trends in Ecology & Evolution. -2000. –V.15. -№ 5. -P.188-192.
17. Hori, T., Asakawa, S., Itoh, Y., Shimizu, N., Mizuno, S. Wpkci, encoding an altered form of PKCI, is conserved widely on the avian W chromosome and expressed in early female embryos: implication of its role in female sex determination. // Molec Biol Cell. -2000. -№11. -P.3645– 3660.
18. O’Neill, M., Binder, M., Smith, C. A., Andrews, J., Reed, K., Smith, M.J., Millar, C., Lambert, D., Sinclair, A. H. ASW: a gene with conserved avian W-linkage and female specific expression in chick embryonic gonad. // Dev Gen Evol. -2000. -№210. -P.243–249.
19. Smith, C. A. and Sinclair, A. H. Sex determination: insights from the chicken. // Bioessays. -2004. –V.26. -№ 2. -P.120-32.
20. McQueen, H., McBride, D., Miele, G., Bird, A. P., Clinton, M. Dosage compensation in birds. // Curr Biol. -2001. -№11. -P.253–257.
21. Kuroda, Y., Arai, N., Arita, M., Teranishi, M., Hori, T., Harata, M., Mizuno, S. Absence of Z-chromosome inactivation for five genes in male chickens.// Chrom Res. -2001. -№9. -P.457–468.
22. Smith, C. A., McClive, P. J., Western, P. S., Reed, K. J., Sinclair, A. H. Conservation of a sex-determining gene. // Nature. -1999. -№ 402. -P.601–602.
23. Raymond, C. S., Kettlewell, J.R., Hirsch, B., Bardwell, V.J., Zarkower, D. Expression of Dmrt1 in the genital ridge of mouse and chicken embryos suggests a role in vertebrate sexual development.// Dev Biol. -1999. -№ 215. -P.208–220.
24. Smith, C. A., Katz, M., Sinclair, A, H. DMRT1 is up-regulated in the gonads during female-to-male sex reversal in ZW chicken embryos. // Biol. Reprod. -2003. -№ 68. -P.560–570.
25. Raymond, C. S., Shamu, C. E., Shen, M. M., Seifert, K. J., Hirsch, B., Hodgkin, J., Zarkower, D. Evidence for evolutionary conservation of sex-determining genes. // Nature. -1998. -№ 391. -P.691–695.
26. Shetty, S., Kirby, P., Zarkower, D. & Graves, J. A. DMRT1 in a ratite bird: evidence for a role in sex determination and discovery of a putative regulatory element. // Cytogenet. Genome Res. -2002. -№ 99. -P. 245–251.
27. Shoemaker, C., Ramsey, M., Queen, J. & Crews, D. Expression of Sox9, Mis, and Dmrt1 in the gonad of a species with temperature-dependent sex determination. // Dev. Dyn. -2007. -№ 236. -P. 1055–1063.
28. Kettlewell, J. R., Raymond, C. S. and Zarkower, D. Temperature-dependent expression of turtle Dmrt1 prior to sexual differentiation. // Genesis. -2000. -№ 26. -P. 174–178.
29. Matsuda, M. et al. DMY is a Y-specific DM-domain gene required for male development in the medaka fish.// Nature. -2002. . -№ 417. -P. 559–563.
30. Teranishi, M., et al. Transcripts of the MHM region on the chicken Z chromosome accumulate as non-coding RNA in the nucleus of female cells adjacent to the DMRT1 locus. // Chrom. Res. -2001. -№9. -P. 147–165.
31. Kozielska, M., Weissing, F. J., Beukeboom, L. W. and Pen, I. Segregation distortion and the evolution of sex-determining mechanisms. // Heredity. – 2010. -№ 104. –P.100–112.
32. Jaenike, J. Sex chromosome meiotic drive. // Annu. Rev. Ecol. Syst. -2001. -№ 32. –P.25–49.
33. Bull, J. J. and Charnov, E. L...Changes in the heterogametic mechanism of sex determination // Heredity. -1977. -№39. –P.1–14.
34. Taylor, D. R., Ingvarsson, P. K. Common features of segregation distortion in plants and animals.// Genetica. -2003. -№117. –P.27–35.
35. Fuge, H. Unorthodox male meiosis in Trichosia pubescens (Sciaridae)—chromosome elimination involves polar organelle degeneration and monocentric spindles in first and 2nd division. // J. Cell Sci. -1994. -№ 107. –P.299–312.
36. Underwood, D. L.A. and Shapiro, A. M. A male-biased primary sex ratio and larval mortality in Eucheira socialis (Lepidoptera:Pieridae). // Evol. Ecol. Res. -1999. -№1. –P.703–717.
37. Fredga, K., Gropp, A., Winking, H. and Frank, F. Fertile Xx-type and Xy-typefe males in wood lemming Myopus schisticolor // Nature. -1976. -№ 261. –P.225–227.
38. Rutkowska, J. and Badyaev, A.V. Meiotic drive and sex determination: molecular and cytological mechanisms of sex ratio adjustment in birds // Phil. Trans. R. Soc. B. -2008. -№ 363. –P. 1675—1686.
39. Young, R. L. and Badyaev, A. V. Evolution of sex-biased maternal effects in birds: I. Sex-specific resource allocation among simultaneously growing oocytes. // J. Evol. Biol. -2004. -№ 17, -P.1355–1366.
40. Francis, R. C. & Barlow, G. W. Social control of primary sex differentiation in the Midas cichlid. // Proceedings of the National Academy of Sciences. -1993. -№ 90. -P.10673-10675.
41. Holmgren, K. and Mosegaard, H. Implications of individual growth status on the future sex of the European eel.// Journal of Fish Biology. -1996. -№ 49. -P. 910-925.
42. Fisher, R. A. The genetical theory of natural selection // Oxford Univ. Press. -1930. -47 p.
43. Pieau, C. and Dorizzi, M. Oestrogens and temperature-dependent sex determination in reptiles: all is in the gonads //Journal of Endocrinology. — 2004. -№ 181. –P. 367–377.
44. McCarrey J. R., Abbott, U. K. Chicken gonad differentiation following excision of primordial germ cells. // Dev Biol. -1978. -№ 66. –P. 256–265.
45. McCarrey, J.R., Abbott U.K. Functional differentiation of chick gonads following depletion of primordial germ cells. // J. Embryol Exp Morph. -1982. -№ 68. –P. 161–174.
46. McLaren, A. Development of the mammalian gonad: the fate of the supporting cell lineage. // BioEssays. -1991. -№13. –P. 151–156.
47. Yao, H.H., Tilman, C., Zhao, G.Q., Capel, B. The battle of the sexes: opposing pathways in sex determination. // Novartis Found Symposium. -2002. -№ 244. –P. 187–198.
48. Elbrecht, A., Smith, R. G. Aromatase enzyme activity and sex determination in chickens. // Science. -1992. -№ 255. –P. 467–470.
49.Vaillant, S., Dorizzi, M., Pieau, C, Richard-Mercier N. Sex reversal and aromatase in chicken. // J Exp Zool. -2001. -№ 290. –P. 727–740.
50. Nishikimi, H., N. Kansaku, et al. Sex differentiation and mRNA expression of p450c17, p450arom and AMH in gonads of the chicken. // Molecular Reproduction and Development -2000. V.55. -№ 1. –P. 20-30.
51. Maraud, R., Vergnaud, O., Rashedi, M. New insights on the mechanism of testis differentiation from the morphogenesis of experimentally induced testes in genetically female chicken embryos. // Am J Anat. -1990. -№ 188. –P. 429– 437.
52. Behringer, R. R., Finegold, M. J., Cate, R.L. Mullerian inhibiting substance function during mammalian sexual development. // Cell. -1994. -№ 79. –P. 415–425.
53. Smith, C. A., Smith, M. J., Sinclair, A. H. Gene expression during gonadogenesis in the chicken embryo. // Gene. -1999. -№ 234. –P. 395–402.
54. Nakamura, M., Kobayashi, T., Chang, X-T., Nagahama, Y. Gonadal sex differentiation in teleost fish. // J. Exp. Zool. -1998. -№ 281. –P. 362–372.
55. Hayes, T. Sex determination and primary sex differentiation in amphibians: genetic and developmental mechanisms. // J. Exp. Zool. -1998. -№ 281. –P. 373–399.
56. Pieau, C. Temperature variation and sex determination in reptiles. // Bioessays. -1996. -№ 18. –P. 19–26.
57. Scheib, D. Effects and role of estrogens in avian gonadal differentiation. // Differentiation -1983. -№ 23. –P. 87–92.
58. Coveney, D., Shaw, G., Renfree, M. B. Estrogen-induced gonadal sex reversal in the tammar wallaby. // Biol. Reprod. -2001. -№ 65. –P. 613–621.
59. Jost, A. Hormonal factors in the sex differentiation of the mammalian foetus. // Phil. Trans. R. Soc. Lond. -1970. -№ 259. –P. 119–130.
60. Hu, M.C., Hsu, N.C., El Hadj, N.B., Pai, C.I., Chu, H.P., Wang, C.K., Chung, B.C. Steroid deficiency syndromes in mice with targeted disruption of CYP11A1. // Mol Endocinol -2002. -№16. –P. 1943–1950.
61. Tazawa, H. and Rahn, H. Temperature and metabolism of chick embryos and hatchlings after prolonged cooling. // Journal of Experimental Zoology/ Suppl. -1987. №1. –P. 105-109.
62. Quinn, A. E., Georges, A., Sarre, S. D., Guarino, F., Ezaz, T., Graves, J. A. M. Temperature sex reversal implies sex gene dosage in a reptile. // Science. -2007. –P. 316-411.
63. Ferguson, M. W.,J. Temperature dependent sex determination and growth in reptiles and manipulation of poultry sex by incubation temperature. // In Proceedings of the 9th European
Poultry Conference in Glasgow. -1994a. –P.380-382.
64. Ferguson, M. W. J. Method of hatching avian eggs. // Patent WO 94/13132. -1994b.
65.Тагиров, M. T. Смещение полового соотношения у кур после продолжительного хранения яиц. // Биотехнология. – 2010. -Том. 3. -N. 3. -С. 84-90.
Сокращения
DMRT1: doublesex and mab-3 related transcription factor 1.
SRY: Sex Region on the Y chromosome.
ASW (то же, что и HINTW или Wpkci): Avian Sex-specific gene on W chromosome.
Wpkci :Protein Kinase C Inhibitor.
FET1: Female- Expressed Transcript1, on chicken W.
HMG box: shared with High Mobility Group proteins.
SOX9: член семейства генов, связанного с SRY геном и содержащего HMG box.
Is it possible to regulate avian sex ratio?
Summary.
The modern conception of genetic bases of bird’s sex determination is presented. Following the genotypic mechanism of sex determination birds implement a complex system of sex chromosome relationships. Z chromosome contains a dose-dependent male sex determinant – gene DMTR1, which ensure the testicles development upon two copy availability in the ZZ combination. Some factors on the W chromosome not yet identified suppress the activity of the DMTR1 gene on the one hand, and activate the aromatase enzyme on the other hand, which in ZW combination promote to the female sex development. A hypothesis according which as various animal classes develop adaptations ensuring stable embryo development the dependence of sex determination upon environment and inner signals at the late stages of development is reduced and at the same time sex determinants fixed in the genome and active at the very early stages of development appear is proposed.
Key words: bird, sex determination, sex chromosomes, sex inversion, meiotic drive, gonads.